Le développement de thérapies ciblées et des techniques d’imagerie est un défi majeur en santé, particulièrement dans les pathologies cancéreuses. Les cancers du péritoine ou carcinoses péritonéales sont habituellement causées par une dissémination de cellules tumorales au sein de la cavité abdominale, ce qui est le cas de 85% des patientes atteintes d'un cancer ovarien et plus de 10% des patients atteints d’un cancer colorectal. Dans les deux cas, les traitements consistent en une chirurgie (cytoréduction), aussi complète que possible, accompagnée de chimiothérapies. L'amélioration de la survie globale des patients passe par le développement de technologies parallèles comme de nouveaux outils diagnostiques pour détecter des implantations précoces dans le péritoine, ou encore la combinaison de chimiothérapies et de traitements ciblés intrapéritonéaux.
Pour améliorer cette détection, l’équipe de recherche a ciblé une modification des glycosylations, portée par différentes glycoprotéines membranaires, spécifique des cellules tumorales d’origine épithéliale, l’antigène Thomsen-Friedenreich (TF) ou CD176. La sonde utilisée est une protéine, appartenant à la famille des lectines, qui reconnait spécifiquement cette glycosylation aberrante. Des souris ont été xénogreffées avec des cellules tumorales ovariennes injectées directement dans la cavité abdominale. Le protocole de greffe a été mis au point pour obtenir des nodules dont la taille moyenne est inférieure au mm3, correspondant à la limite actuelle de détection en chirurgie, et dont les sites d’implantation sont identiques à ceux retrouvés dans la pathologie humaine. La protéine a été marquée par un groupement fluorescent dans le proche infrarouge, puis injectée en intrapéritonéal aux animaux.
Afin de mimer deux situations cliniques, la sonde a été injectée à deux moments différents. D’une part, 3 semaines après avoir réalisé la greffe de cellules tumorales pour détecter les nodules correspondant à une rechute déjà établie. Dans ce cas, il a été possible de détecter des nodules 20 fois plus petits que les systèmes actuels de détection. D’autre part, la sonde a été injectée en même temps que les cellules tumorales, c'est-à-dire au moment de la greffe. Cette seconde situation correspond à ce qui se passe juste après la cytoréduction chirurgicale au cours de laquelle des cellules tumorales peuvent se disséminer dans le péritoine, se réimplanter et conduire à des rechutes dans un délai de plusieurs mois ou années (effet iatrogène). Ce protocole a permis de démontrer qu’il était possible de détecter la présence de ces cellules pendant une durée supérieure à 3 semaines.
Les scientifiques avaient démontré l’an dernier que cette protéine permettait également de transporter de petites molécules chimio-thérapeutiques directement aux cellules tumorales[1]. La combinaison de ces deux propriétés ouvre aujourd’hui la porte à des approches théranostiques dans lesquelles la thérapie et le diagnostic par imagerie sont couplés et réalisés avec un seul nano-objet.
Ce travail a été réalisé en collaboration avec l’ICR-IUCT Oncopole et la société Urosphere.
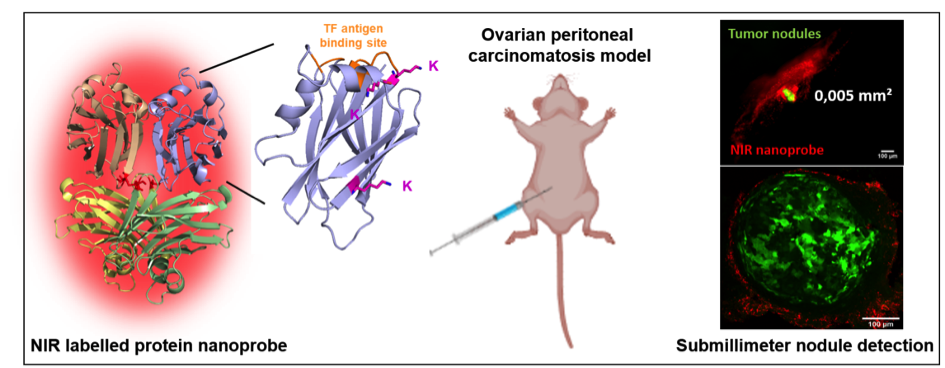
La protéine a été marquée dans le proche infrarouge (Alexa 647) et injectée dans le péritoine de souris porteuses de tumeurs ovariennes. Des nodules de très petite taille ont été détectés (droite en haut). La limite de détection est environ 20 fois supérieure par rapport aux systèmes actuels. Les nodules ont été prélevés (droite en bas) et analysés en microscopie confocale (vert : cellules tumorales ; rouge : sonde fluorescente).
[1] Nanoscale, 2019, 11, 3248 – 3260
Référence :
Development of a near infrared protein nanoprobe targeting Thomsen-Friedenreich antigen for intraoperative detection of submillimeter nodules in an ovarian peritoneal carcinomatosis mouse model, Mathilde COUSTETS, Caroline LADURANTIE, Elisabeth BELLARD, Mélissa PRAT, Marie-Pierre ROLS, Vincent ECOCHARD, Gwenaël FERRON, Sophie CHABOT, Muriel GOLZIO, Laurent PAQUEREAU* Biomaterials, Volume 241, 2020, Article 119908
https://doi.org/10.1016/j.biomaterials.2020.119908
Contacts :
Laurent Paquereau, Professeur à l'université Toulouse III - Paul Sabatier / IPBS
Francoise Viala, chargée de communication à l'IPBS